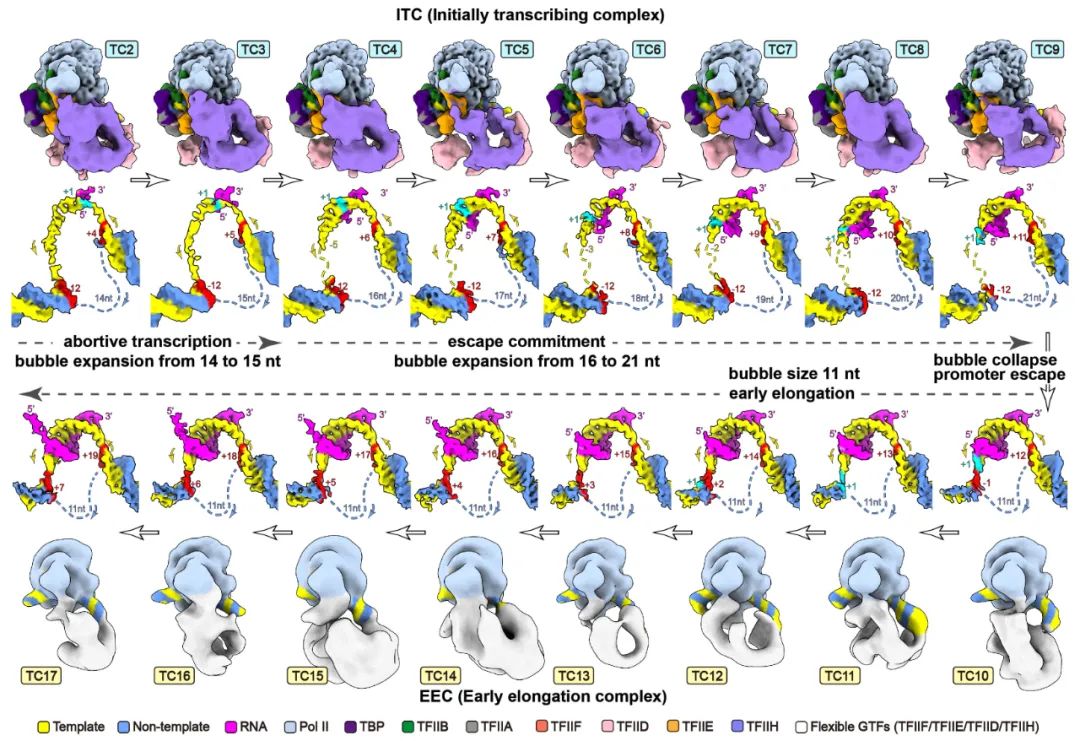
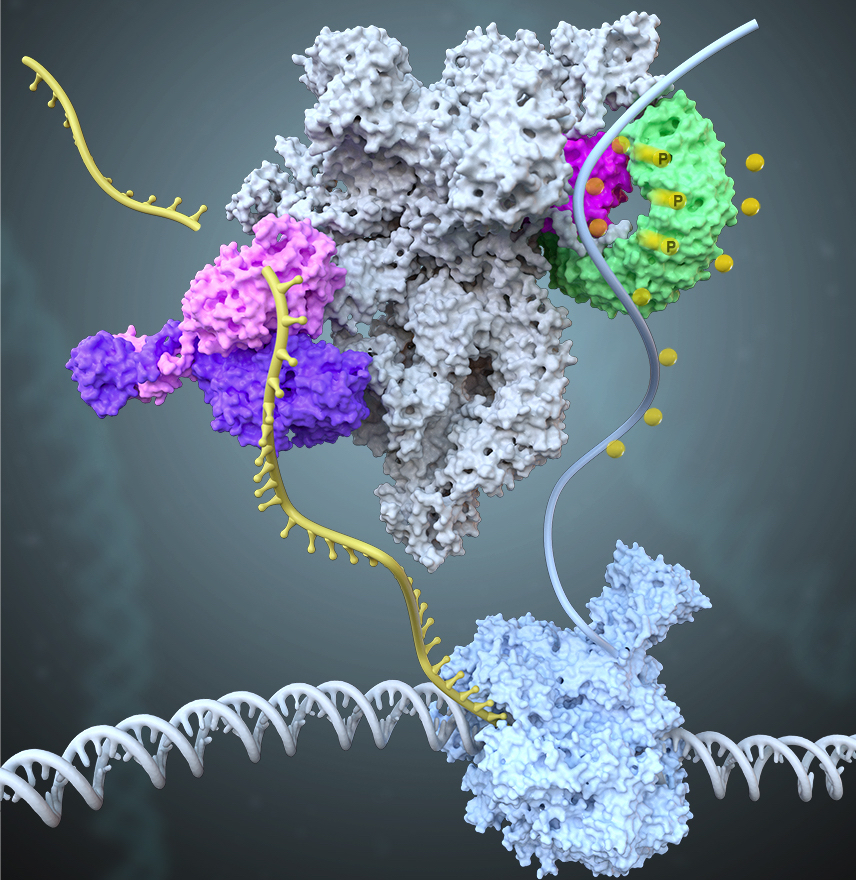
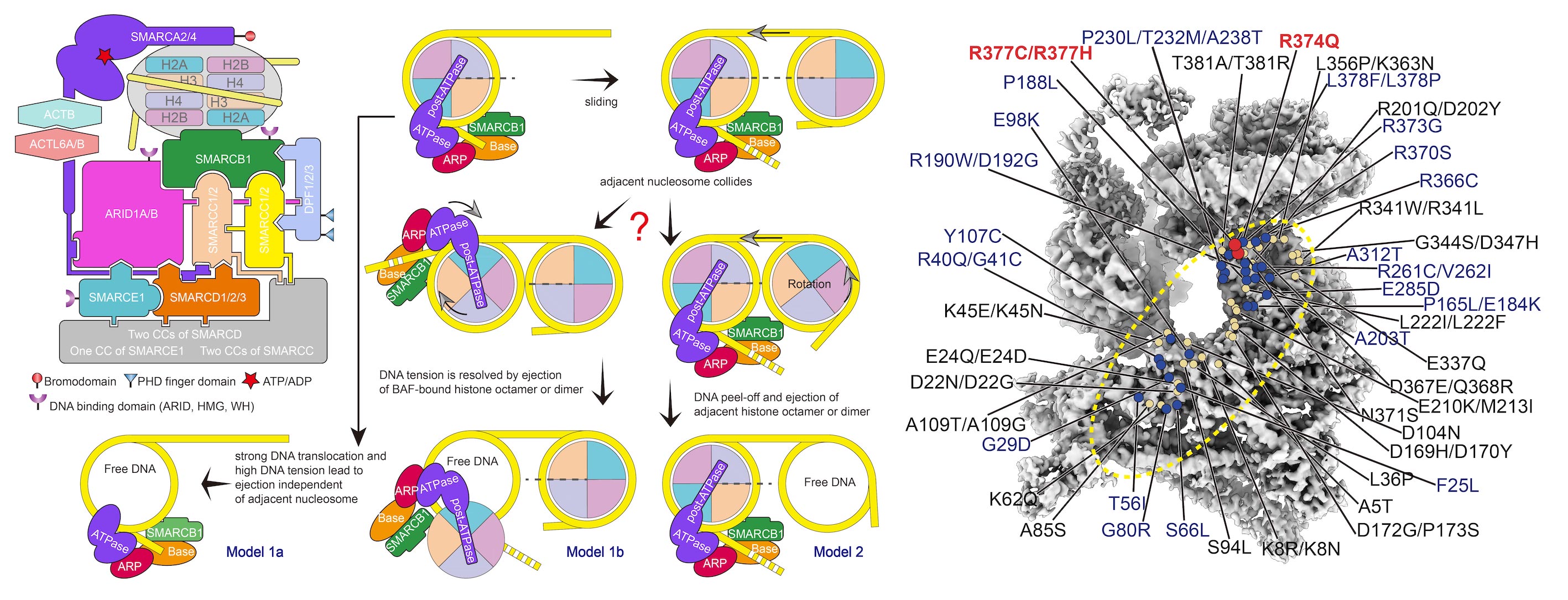
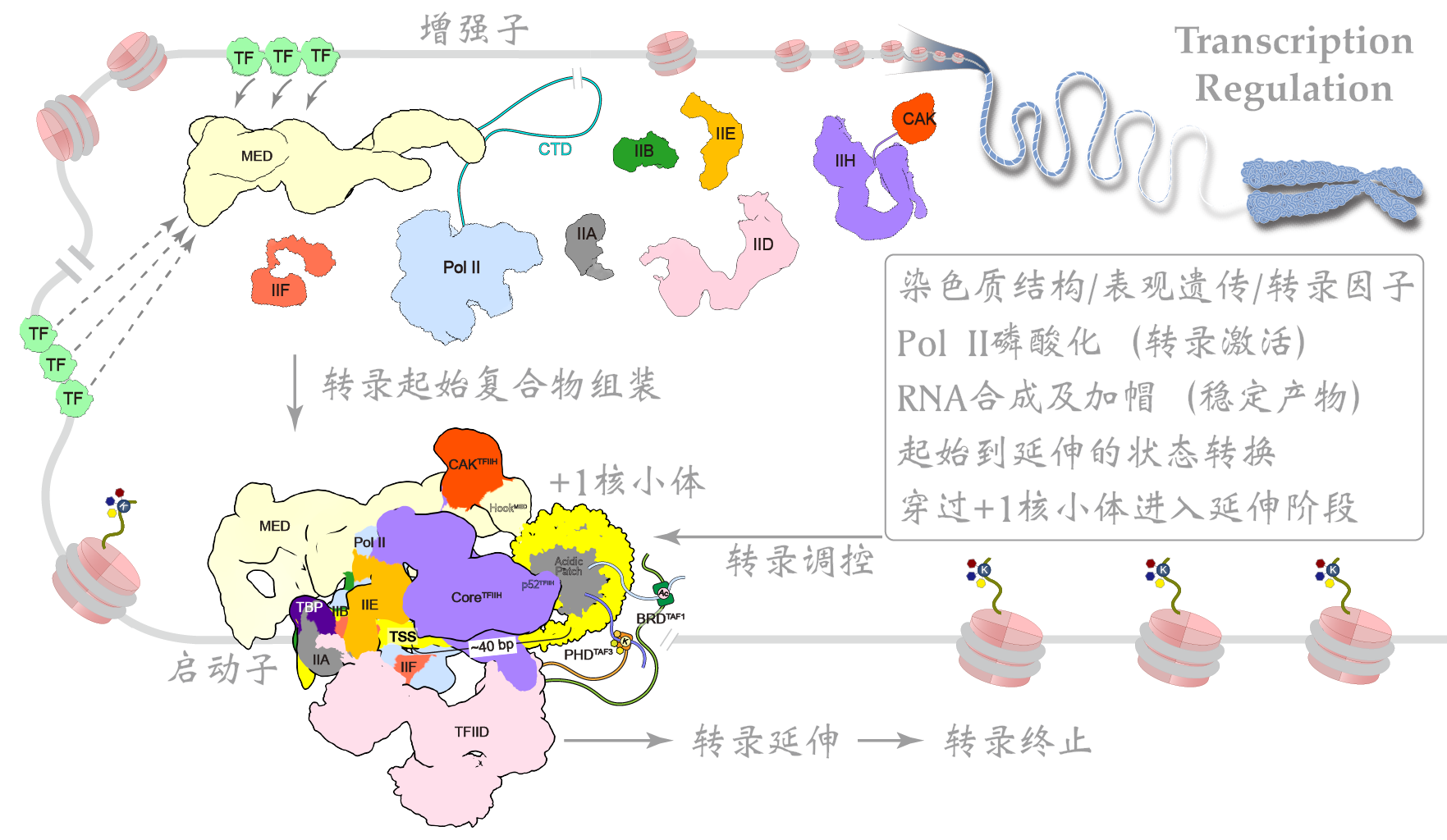
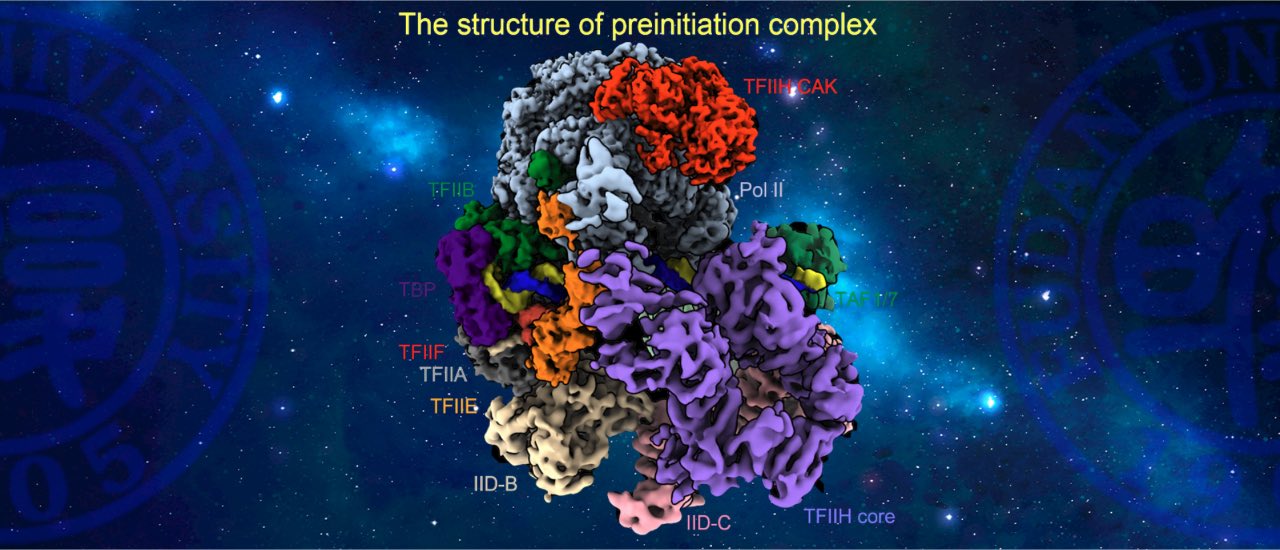
RNA聚合酶II(Pol II)本身不具备结合和打开基因启动子的能力,需要与6个通用转录因子(general transcription factors,GTFs)包括TFIID、TFIIA、TFIIB、TFIIF、TFIIE以及TFIIH共同在启动子上组装形成转录前起始复合物(preinitiation complex,PIC),才能起始转录。在ATP的驱动下,TFIIH将转录起始位点附近的DNA双链打开,模板链进入Pol II的活性中心,PIC转变形成了初始转录复合物(initially transcribing complex, ITC);随后,Pol II以NTP为底物,催化合成RNA,期间经历一系列复杂的结构和复合物组成变化,ITC转变形成早期延伸复合物(early elongation complex, EEC),进入后续的延伸过程。以往众多生化实验描绘出了转录起始的大致过程,但由于实验设计和实验材料的不一致,不同的实验结论之间相互矛盾,许多结论长期以来未得到统一。
我们将转录反应人为的暂停在转录起始位点下游2-17位核苷酸的位置,首次用结构重现出了转录从头起始的16个连续动态全过程,揭示了通用转录因子(GTFs)和转录泡协同RNA聚合酶Pol II调控转录起始向转录延伸转变的分子机制 (
Science, 2023)。将过去几十年来数百篇关于转录起始研究中的众多看似矛盾的结论作了统一。回答了起始过程中众多核心问题,揭示了转录起始调控的机制,为理解基因表达调控奠定了结构基础。

 MOVIE
MOVIE